Indicaciones, información de seguridad importante e información de prescripción
BOTOX® Cosmético (onabotulinumtoxinA) Información importante
indicaciones
BOTOX® Cosmetic (onabotulinumtoxinA) está indicado en pacientes adultos para la mejora temporal en la apariencia de:
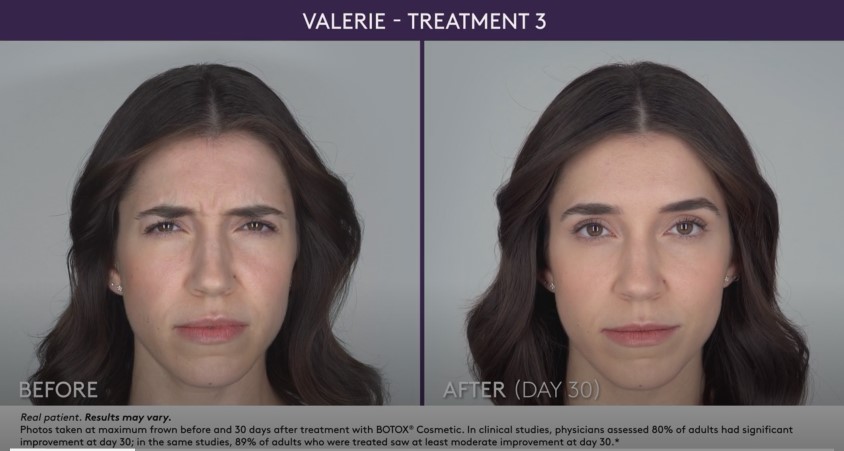
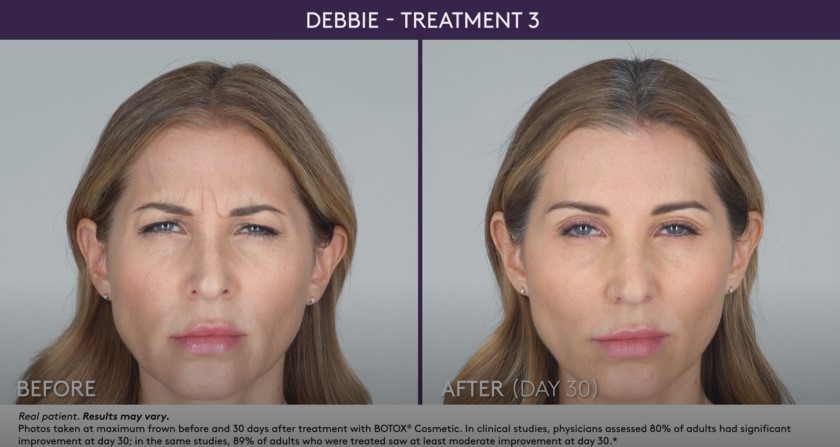
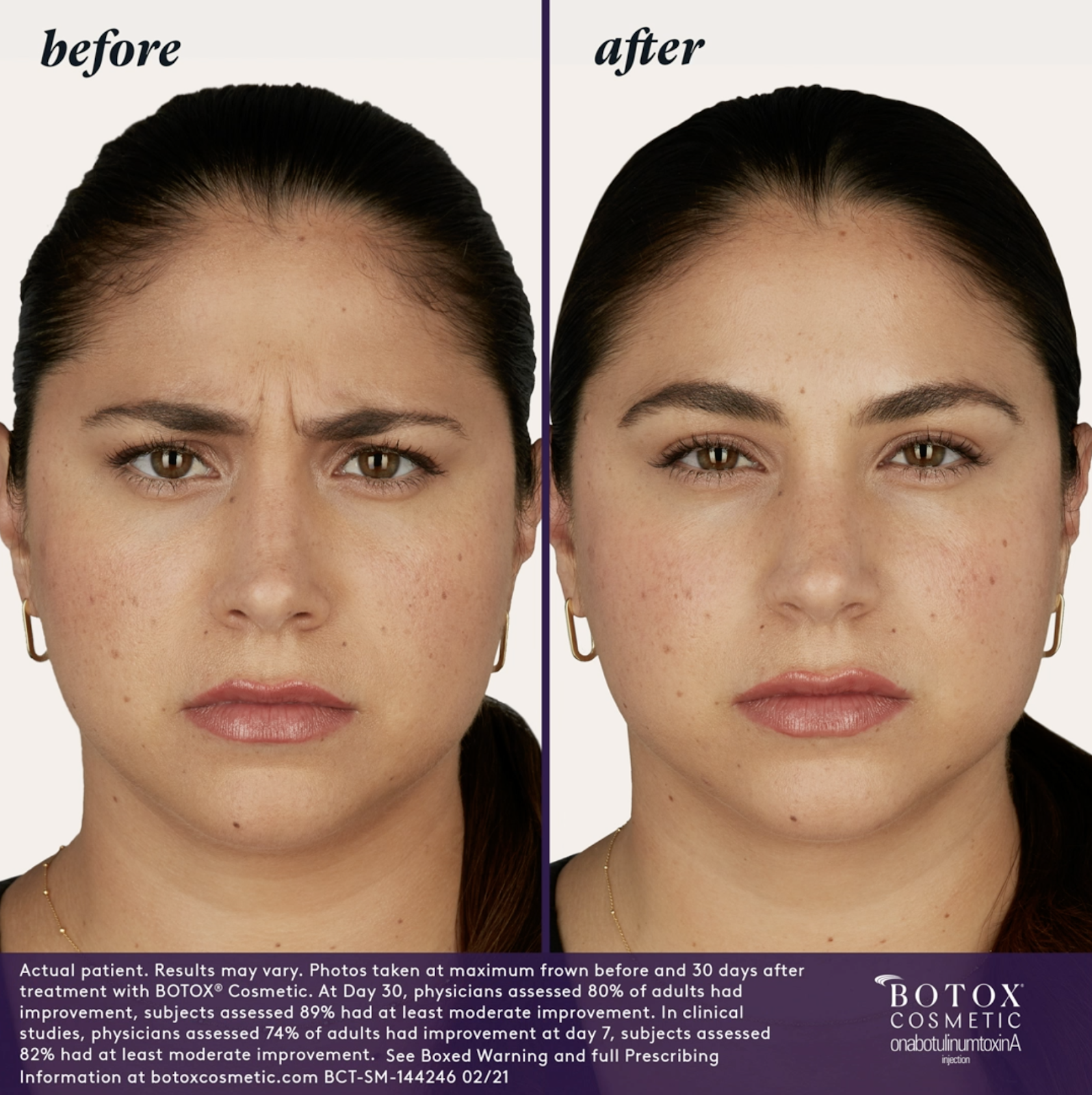
– Líneas glabelares de moderadas a severas asociadas con la actividad del músculo corrugador y/o prócero
– Líneas cantales laterales moderadas a severas asociadas con actividad del orbicular de los párpados
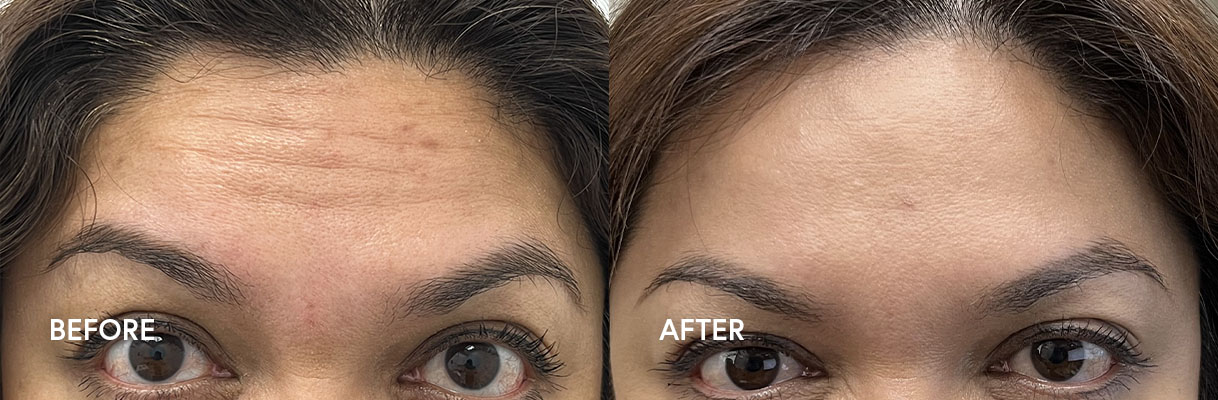
– Líneas de la frente de moderadas a severas asociadas con la actividad frontal
INFORMACIÓN IMPORTANTE DE SEGURIDAD, INCLUIDA LA ADVERTENCIA EN RECUADRO
ADVERTENCIA: PROPAGACIÓN A DISTANCIA DEL EFECTO DE LA TOXINA
Los informes posteriores a la comercialización indican que los efectos de BOTOX® Cosmetic y todos los productos de toxina botulínica pueden extenderse desde el área de inyección para producir síntomas compatibles con los efectos de la toxina botulínica. Estos pueden incluir astenia, debilidad muscular generalizada, diplopía, ptosis, disfagia, disfonía, disartria, incontinencia urinaria y dificultades respiratorias. Estos síntomas se han informado horas o semanas después de la inyección. Las dificultades para tragar y respirar pueden poner en peligro la vida y ha habido informes de muerte. El riesgo de síntomas es probablemente mayor en niños tratados por espasticidad, pero los síntomas también pueden ocurrir en adultos tratados por espasticidad y otras afecciones, particularmente en aquellos pacientes que tienen una afección subyacente que los predispondría a estos síntomas. En usos no aprobados e indicaciones aprobadas, se han notificado casos de propagación del efecto a dosis comparables a las utilizadas para tratar la distonía cervical y la espasticidad ya dosis más bajas.
CONTRAINDICACIONES
BOTOX® Cosmetic está contraindicado en presencia de infección en los sitios de inyección propuestos y en personas con hipersensibilidad conocida a cualquier preparación de toxina botulínica o a cualquiera de los componentes de la formulación.
ADVERTENCIAS Y PRECAUCIONES
Falta de intercambiabilidad entre productos de toxina botulínica
Las unidades de potencia de BOTOX® Cosmetic son específicas para el método de preparación y ensayo utilizado. No son intercambiables con otras preparaciones de productos de toxina botulínica y, por lo tanto, las unidades de actividad biológica de BOTOX® Cosmetic no se pueden comparar ni convertir en unidades de ningún otro producto de toxina botulínica evaluado con ningún otro método de ensayo específico.
Propagación del efecto de la toxina
Consulte el recuadro de advertencia para la propagación a distancia del efecto de la toxina.
No hay informes definitivos de eventos adversos serios de propagación a distancia del efecto de la toxina asociados con el uso dermatológico de BOTOX® Cosmetic a la dosis etiquetada de 20 Unidades (para líneas glabelares), 24 Unidades (para líneas cantales laterales), 40 Unidades (para líneas de la frente con líneas glabelares). Se informaron 44 unidades (para el tratamiento simultáneo de líneas cantales laterales y líneas glabelares) y 64 unidades (para tratamiento simultáneo de líneas cantales laterales, líneas glabelares y líneas de la frente). Se debe advertir a los pacientes o cuidadores que busquen atención médica inmediata si se presentan trastornos de la deglución, del habla o respiratorios.
Reacciones adversas graves con uso no aprobado
Se informaron reacciones adversas graves, que incluyen debilidad excesiva, disfagia y neumonía por aspiración, con algunas reacciones adversas asociadas con desenlaces fatales, en pacientes que recibieron inyecciones de BOTOX® para usos no aprobados. En estos casos, las reacciones adversas no estaban necesariamente relacionadas con la propagación a distancia de la toxina, sino que pueden haber resultado de la administración de BOTOX® en el lugar de la inyección y/o estructuras adyacentes. En varios de los casos, los pacientes tenían disfagia preexistente u otras discapacidades significativas. No hay información suficiente para identificar los factores asociados con un mayor riesgo de reacciones adversas asociadas con los usos no aprobados de BOTOX®. No se ha establecido la seguridad y eficacia de BOTOX® para usos no aprobados.
Reacciones hipersensibles
Se han notificado reacciones de hipersensibilidad graves y/o inmediatas. Estas reacciones incluyen anafilaxia, enfermedad del suero, urticaria, edema de partes blandas y disnea. Si ocurren tales reacciones, se debe suspender la inyección adicional de BOTOX® Cosmetic e instituir inmediatamente la terapia médica adecuada. Se ha informado un caso fatal de anafilaxia en el que se usó lidocaína como diluyente y, en consecuencia, no se puede determinar con certeza el agente causal.
Sistema Cardiovascular
Ha habido informes después de la administración de BOTOX® de eventos adversos que involucran el sistema cardiovascular, incluyendo arritmia e infarto de miocardio, algunos con desenlaces fatales. Algunos de estos pacientes tenían factores de riesgo, incluida la enfermedad cardiovascular preexistente. Tenga cuidado cuando se administre a pacientes con enfermedad cardiovascular preexistente.
Mayor riesgo de efectos clínicamente significativos con trastornos neuromusculares preexistentes
Las personas con enfermedades neuropáticas motoras periféricas, esclerosis lateral amiotrófica o trastornos de la unión neuromuscular (p. ej., miastenia grave o síndrome de Lambert-Eaton) deben ser monitoreadas cuando se les administre toxina botulínica. Los pacientes con trastornos neuromusculares pueden tener un mayor riesgo de efectos clínicamente significativos que incluyen debilidad muscular generalizada, diplopía, ptosis, disfonía, disartria, disfagia grave y compromiso respiratorio por onabotulinumtoxinA (ver Advertencias y precauciones).
Disfagia y Dificultades Respiratorias
El tratamiento con BOTOX® y otros productos de toxina botulínica puede provocar dificultades para tragar o respirar. Los pacientes con dificultades preexistentes para tragar o respirar pueden ser más susceptibles a estas complicaciones. En la mayoría de los casos, esto es consecuencia del debilitamiento de los músculos en el área de la inyección que están involucrados en la respiración o de los músculos orofaríngeos que controlan la deglución o la respiración (ver Advertencia en caja).
Condiciones preexistentes en el sitio de inyección
Se debe tener precaución cuando se utiliza el tratamiento cosmético con BOTOX® en presencia de inflamación en los sitios de inyección propuestos o cuando hay debilidad o atrofia excesivas en los músculos objetivo.
Ojo seco en pacientes tratados con BOTOX® Cosmetic
Ha habido informes de ojo seco asociado con la inyección cosmética de BOTOX® en o cerca del músculo orbicular de los párpados. Si los síntomas del ojo seco (p. ej., irritación ocular, fotofobia o cambios visuales) persisten, considere derivar a los pacientes a un oftalmólogo.
Albúmina humana y transmisión de enfermedades virales
Este producto contiene albúmina, un derivado de la sangre humana. Basado en procesos efectivos de detección de donantes y fabricación de productos, conlleva un riesgo extremadamente remoto de transmisión de enfermedades virales y variantes de la enfermedad de Creutzfeldt-Jakob (vCJD). Existe un riesgo teórico de transmisión de la enfermedad de Creutzfeldt-Jakob (CJD), pero si ese riesgo realmente existe, el riesgo de transmisión también se consideraría extremadamente remoto. Nunca se han identificado casos de transmisión de enfermedades virales, CJD o vCJD para la albúmina con licencia o la albúmina contenida en otros productos con licencia.
REACCIONES ADVERSAS
Las reacciones adversas notificadas con mayor frecuencia después de la inyección de BOTOX® Cosmético para las líneas glabelares fueron ptosis palpebral (3 %), dolor facial (1 %), paresia facial (1 %) y debilidad muscular (1 %).
La reacción adversa notificada con mayor frecuencia después de la inyección de BOTOX® Cosmetic para las líneas cantales laterales fue edema palpebral (1%).
Las reacciones adversas notificadas con mayor frecuencia después de la inyección de BOTOX® Cosmetic para las líneas de la frente con líneas glabelares fueron dolor de cabeza (9 %), ptosis de la frente (2 %) y ptosis de los párpados (2 %).
INTERACCIONES CON LA DROGAS
La coadministración de BOTOX® Cosmetic y aminoglucósidos u otros agentes que interfieren con la transmisión neuromuscular (p. ej., compuestos similares al curare) solo debe realizarse con precaución, ya que se puede potenciar el efecto de la toxina. El uso de fármacos anticolinérgicos después de la administración de BOTOX® Cosmetic puede potenciar los efectos anticolinérgicos sistémicos.
Se desconoce el efecto de administrar diferentes productos de neurotoxina botulínica al mismo tiempo o con varios meses de diferencia. La debilidad neuromuscular excesiva puede verse exacerbada por la administración de otra toxina botulínica antes de la resolución de los efectos de una toxina botulínica administrada previamente.
La debilidad excesiva también puede ser exagerada por la administración de un relajante muscular antes o después de la administración de BOTOX® Cosmetic.
USO EN POBLACIONES ESPECÍFICAS
No existen estudios o datos adecuados de vigilancia posterior a la comercialización sobre el riesgo de desarrollo asociado con el uso de BOTOX® Cosmético en mujeres embarazadas. No hay datos sobre la presencia de BOTOX® Cosmético en la leche humana o animal, los efectos sobre el niño amamantado o los efectos sobre la producción de leche.
Por favor vea BOTOX® cosmético completo Información de prescripción incluyendo advertencia en caja y Guía de medicación.
Contáctanos hoy mismo
Complete el siguiente formulario y alguien responderá en breve. También puedes llamar 516-833-1301 con cualquier pregunta que pueda tener.